2025年成考高起点每日一练《理化综合》5月17日专为备考2025年理化综合考生准备,帮助考生通过每日坚持练习,逐步提升考试成绩。
单选题
1、有两颗人造地球卫星,在半径分别为R1、R2的圆轨道上做匀速圆周运动,R2>R1.两个卫星的运动速率分别为v1 和v2,周期为T1和T2,则有()
- A:v1<v2,T1<T2
- B:v1<v2,T1>T2
- C:v1>v2,T1<T2
- D:.v1>v2,T1>T2
答 案:C
2、用26.4g(NH4)2SO4跟过量Ca(OH)2混合加热,放出的气体全部被含有0.4molH3PO4的溶液吸收,生成的盐是()。
- A:(NH4)3PO4
- B:NH4H2PO4
- C:(NH4)2HPO4
- D:(NH4)3PO4和(NH4)2HPO4
答 案:B
解 析:(1)首先应知道(NH4)2SO4(铵盐)跟过量Ca(OH)2(碱)反应,生成的气体是NH3。设反应生成NH3xmol,则 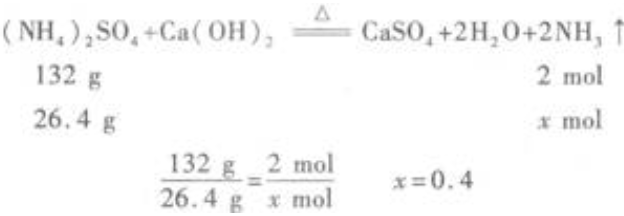 (2)NH3与H3PO4反应生成铵盐,但因H3PO4是三元酸,所以按NH3与H3PO4的物质的量之比的不同,可得到3种产物。
(2)NH3与H3PO4反应生成铵盐,但因H3PO4是三元酸,所以按NH3与H3PO4的物质的量之比的不同,可得到3种产物。 本题给出n(H3PO4)=0.4mol,又计算出n(NH3)=0.4mol,所以生成的盐的化学式是NH4H2PO4
本题给出n(H3PO4)=0.4mol,又计算出n(NH3)=0.4mol,所以生成的盐的化学式是NH4H2PO4
多选题
1、某溶液中有NH4+、Mg2+、Al3+、Fe2+等4种离子, 若向其中加入过量的 NaOH溶液, 微热并搅拌, 再加入过量的盐酸, 溶液中大量减少的阳离子是
- A:NH4+
- B:Mg2+
- C:Fe2+
- D:Al3+
答 案:AC
主观题
1、工业上用焙烧NaHCO3的方法生产纯碱(Na2CO3)。现有17.5g的NaHCO3样品,加热分解完全后,生成标准状况下的CO2气体2.24L。写出NaHCO3分解反应的化学方程式,计算此NaHCO3样品的纯度。
答 案:NaHCO3分解反应的化学方程式如下: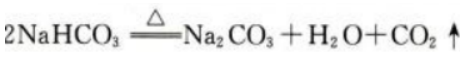 反应生成标准状况下的CO2气体2.24L,其物质的量为0.1mol,故加热完全分解的NaHCO3的物质的量为0.2mol,质量为16.8g,此NaHCO3样品的质量为17.5g,所以此NaHCO3样品的纯度为16.8g/17.5g×100%=96%。
反应生成标准状况下的CO2气体2.24L,其物质的量为0.1mol,故加热完全分解的NaHCO3的物质的量为0.2mol,质量为16.8g,此NaHCO3样品的质量为17.5g,所以此NaHCO3样品的纯度为16.8g/17.5g×100%=96%。
2、如图,一质量为m1的木块静置在光滑的水平面上,一质量为m2的子弹以速度v0水平射入木块,进入木块s距离后相对木块静止。设子弹相对木块静止前受到的阻力恒定。求从子弹开始进入到相对木块静止这段时间内
(1)子弹与木块组成的系统损失的机械能。
(2)木块移动的距离。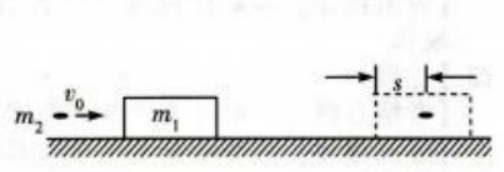
答 案:(1)根据动量守恒定律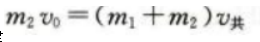 根据功能关系
根据功能关系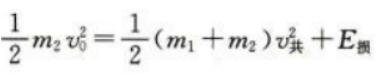
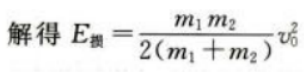 (2)设子弹与木块间摩擦力为f,则E损=fs设物块运动距离为L,对物块运用动能定理
(2)设子弹与木块间摩擦力为f,则E损=fs设物块运动距离为L,对物块运用动能定理
填空题
1、如图5—12所示,一质量M=90g的木块静止在光滑水平桌面上,一质量m=10g的子弹以水平速度v0=400m/s射入木块但未穿出。在此过程中,子弹和木块间的摩擦力对木块所做的功为______,摩擦力对子弹所做的功为______,因摩擦力做功而损失的机械能为______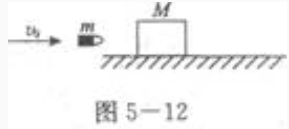
答 案:72J;-792J;720J
2、在pH=4的 三种溶液中,溶质的物质的量浓度最大的是()
三种溶液中,溶质的物质的量浓度最大的是()
答 案:
解 析:强酸在溶液中完全电离,弱酸在溶液中部分电离,在相同的pH时,弱酸的浓度比较大。
简答题
1、如图11—31所示,在轻弹簧的下端悬挂一个边长为l的正方形金属线框。金属线框的下边放在磁感应强度为B的匀强磁场中。当线框中的电流为I时,弹簧保持为原长,线框恰好平衡。现撤去磁场,线框开始向下运动。当线框向下运动到最低点时,弹簧的弹性势能增加了E。求线框下降的距离x。 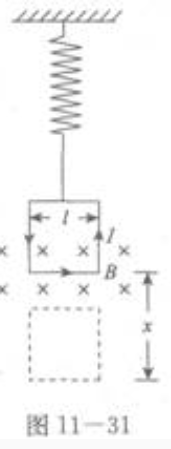
答 案:通电导线在磁场中受安培力作用,利用左手定则,可得线框下边导线受到方向竖直向上的安培力F作用,F=BIL线框还受到竖直向下的重力作用,G=mg.根据题意:F=G.即BIL=mg. 当撤去磁场时,线框在重力作用下,到达最低点时,重力势能减小mgx,弹簧伸长,弹性势能增加E=mgx。由mg=BIL,得x=BIL
2、如图所示,水平放置的平板电容器上极板带负电,下极板带正电,在电容器中,以初速度V0竖直向上抛出一个质量为m、电荷量为-q的带电小球,已知平行板电容器间的匀强电场强度为E,问小球可以到达的最大高度是多少?(假设极板间距足够大)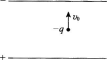
答 案:带电小球在电容器中受重力G和电场力F----e的作用,因为小球带负电荷,所以电场力 
精彩评论